研究背景
類風濕性關節炎(RA) 的診斷主要基于臨床癥狀和類風濕因子(RF),抗瓜氨酸肽抗體(抗 CCP) 的血清學陽性,而銀屑病關節炎(PsA) 只有臨床和影像學特征有助于診斷。雖然大多數 RA 患者 RF,抗 CCP 血清陽性,但約 15%-20% 的 RA 病例中,血清中 RF 和抗 CCP 水平并未升高,由于血清陰性 RA(negRA) 和 PsA 的癥狀非常相似,且沒有可靠的臨床標志物,因此 , 兩者的鑒別診斷十分困難。由于治療方法不同,可靠的診斷對于開出正確的治療處方很重要。此外,導致 RA 和 PsA 患者特征性關節破壞的慢性炎癥過程可能會引起細胞、組織和器官代謝的重大和不同程度的改變。這些代謝改變導致血清代謝物和脂質體的改變。因此研究者對 negRA 和 PsA 患者血清進行了基于 1H NMR 的代謝組學和脂質組學分析,識別 negRA 和 PsA 患者血清中濃度不同的代謝物和脂類。從這些數據中推導出一個模型,將患者分類為兩種疾病類別中的一種,隨后進行了盲法驗證隊列分析,確定生物標志物來提高這些疾病的鑒別診斷。
實驗方法
檢測方法:靶向代謝組學,脂質組學
檢測平臺:NMR
樣本分組:negRA 患者 =49 例;PsA 患者 =73 例
研究結果
核磁共振波譜分析
使用 TopSpin 3.6.2 軟件(Bruker BioSpin GmbH) 處理 NMR 譜。使用 AMix 軟件整合單個已鑒定代謝物的相關光譜區域以進行定量。代謝物濃度的 jué對定量是通過比較來自每個代謝物的信號積分與富馬酸內標的信號積分來實現的。
在 1H 單脈沖 NMR 譜中,同時觀察到來自小分子和大分子的峰,導致基線不均勻和來自不同化合物的信號重疊。盡管如此,由于其特有的光譜特征,可使用 1HNMR 來識別和定量血清中的脂質。如圖 1A 所示,圖中有七組脂質信號(L1-L7):L1:脂質甲基;L2:脂質脂肪鏈;L3:脂質 β - 亞甲基;L4:脂質烯丙基亞甲基;L5:脂質 α - 亞甲基;L6:脂質多不飽和烯丙基亞甲基;L7:脂質烯烴。
在 CPMG NMR 譜中,通過抑制來自脂質和蛋白質的寬信號,所得的低分子化合物的峰不會被來自大分子的信號所掩蓋,且具有清晰的信號和明確的基線,因此可以更好地識別和分析小分子產生的信號。如圖 1B 所示,研究者選擇了 24 中代謝物檢測:(1) 甲酸,(2)組氨酸,(3)苯丙氨酸,(4)酪氨酸,(5)α- 葡萄糖,(6)脯氨酸,(7)乳酸,(8)肌酐,(9)肌酸,(10)磷酸肌酸,(11)蘇氨酸,(12)膽堿,(13)肌氨酸;(14)檸檬酸鹽,(15)谷氨酰胺,(16)琥珀酸鹽,(17)乙酰乙酸鹽,(18)谷氨酸鹽,(19)乙酸鹽,(20)丙氨酸,(21)β- 羥基丁酸酯,(22)纈氨酸,(23)異亮氨酸和(24)亮氨酸。
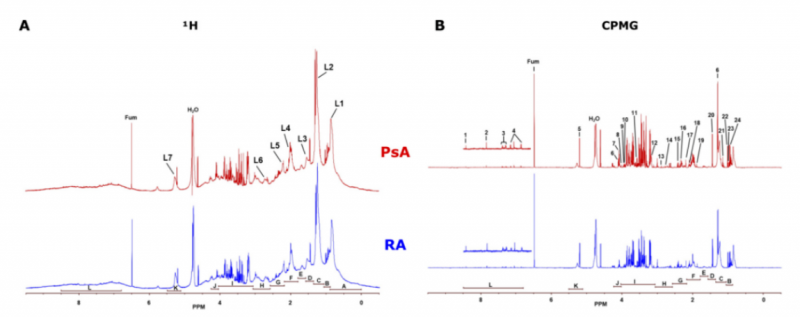 |
圖 1 PsA 和 negRA 患者的光譜特征:1H 單脈沖(A) 和 CPMG NMR(B)
多變量統計分析
對 1H 單脈沖和 CPMG NMR 光譜進行多變量統計分析,以確定是否存在可區分兩種疾病的特征光譜圖或峰。根據偏 zuì小二乘判別分析(PLS-DA)和隨機森林模型,臨床或人口統計學協變量與 1H(圖 1)和 CPMG(數據未顯示)光譜區域之間沒有顯著相關性。
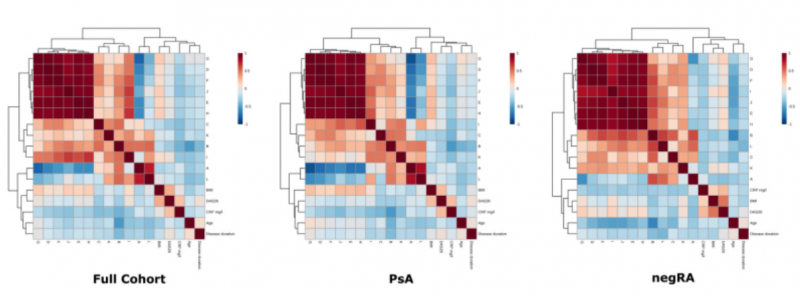 |
圖 2 顯示了臨床 / 人口統計學變量與 1H 光譜區域之間的 Pearson 相關系數,以及用于發現隊列,PsA 和 negRA 組的歐幾里德度量的分層聚類
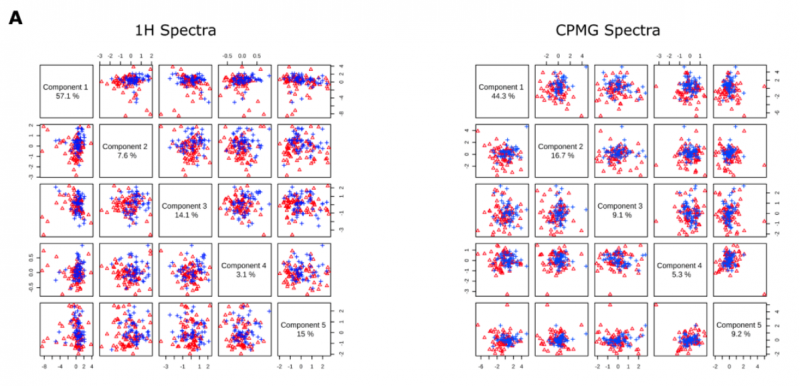
由于基于主成分分析的代謝組學數據的聚類通常很困難,用偏 zuì 小二乘法(PLS-DA) 對 1H 和 CPMG 光譜數據集進行評價。主成分 1 - 5 表明了 1H 數據方差 =96.9%/CPMG 數據方差 =84.6%,但聚類并不明顯,無法清晰區分 PsA 和 negRA 患者(圖 3A)。
圖 3A 五個主成分之間的成對得分曲線圖,對角線上顯示相應的方差。
 |
在評估 PLS-DA 模型的質量時,其準確度≤65%,R2 和 Q2 值都非常低(1H 光譜:R2 = 0.13,Q2 = 0.06;CPMG 光譜:R2 = 0.16,Q2 = 0.08)。為了提高基于光譜模式的診斷準確性,研究者使用了隨機森林分類算法,因為它對高維數據分析具有穩健性。在 1H 和 CPMG 光譜中,該算法鑒定了對 negRA 和 PsA 患者進行分類的相似區域,基于 1H 的分類 oob error=0.361,基于 CPMG 的分類 oob error=0.336(圖 3B,C)。盡管如此,通過隨機森林算法確定的重要光譜區域仍被用于聚焦目標分析。
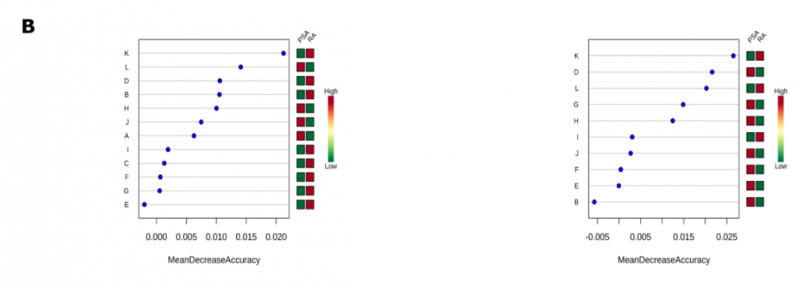 |
圖 3B 隨機森林確定的顯著特征。
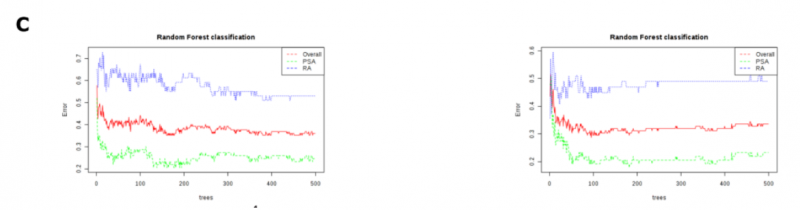 |
圖 3C 隨機森林分類的累積錯誤率。
(紅:總體;藍:RA;綠:PsA)
目標代謝物,脂類聚焦分析
在定量代謝物和脂質組的濃度后,通過單變量分析確定患者組之間的差異。在 24 種代謝物中,兩種患者組中的 9 種具有明顯不同的濃度,即氨基酸(AA):丙氨酸,亮氨酸,苯丙氨酸,蘇氨酸和纈氨酸以及有機化合物乙酸鹽,膽堿,肌酸和乳酸。
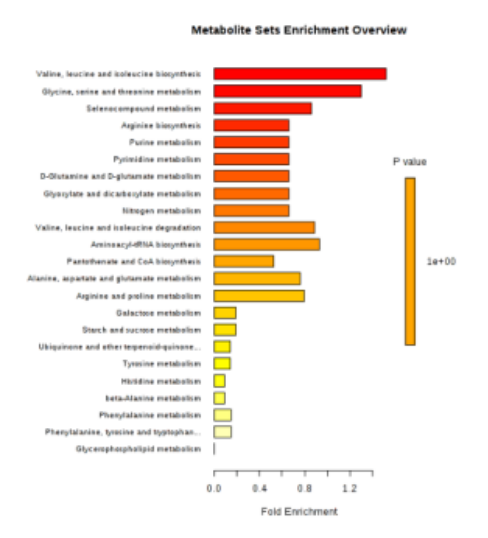
另外發現 negRA 和 PsA 患者之間的脂質比率 L3 / L1,L5 / L1 和 L6 / L1 有統計學差異在 PsA 中均較高(圖 4A)。比較兩組時,某些代謝途徑明顯富集(圖 4B)。
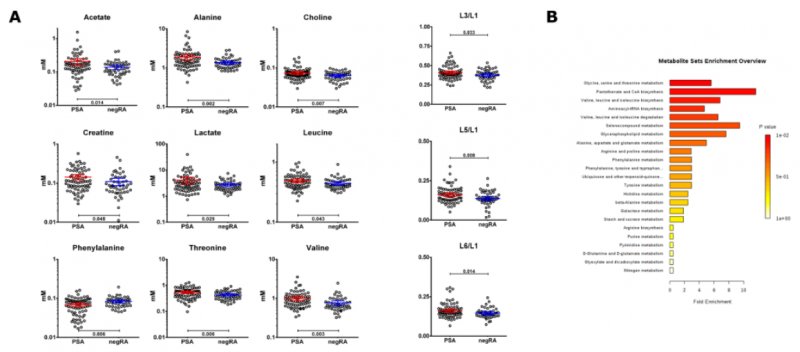 |
圖 4(A)目標分析中包括的代謝物和脂質比率的點狀圖,這些點狀圖顯示了發現隊列中兩個患者組之間的顯著差異。線表示平均值和 95%CI。(B)定量富集分析的摘要條形圖,顯示發現隊列中 negRA 和 PsA 代謝組之間的變化。
多元方差分析(MANOVA)
年齡,性別和治療方案可能會影響不同疾病中生物體液中代謝物的濃度,從而影響要用于初治患者或不同年齡患者的生物標志物的定義。為了分析任何臨床或人口統計學參數是否可能對 24 種代謝物或脂質組的血清濃度產生影響,研究者對相關代謝物和潛在代謝物進行了多元方差分析(MANOVA)。
結果表明(表格未展示)疾病活動與膽堿濃度,L2 / L1 和 L7 / L1 的變化有關,而疾病持續時間與檸檬酸鹽,磷酸肌酸,葡萄糖,組氨酸,酪氨酸和纈氨酸濃度的變化有關。當將年齡和體重指數類別與疾病組結合時,代謝物濃度和脂質比率的變化同樣可見。盡管 RA 是一種主要影響女性的疾病,與 PsA 相反,但 MANOVA 分析結合了疾病類別和性別,在相關代謝產物上沒有任何顯著差異。當疾病和治療相結合時,情況類似。單變量分析顯示代謝物濃度或脂質比率與臨床和人口統計學變量之間有沒有任何顯著相關。如圖 5
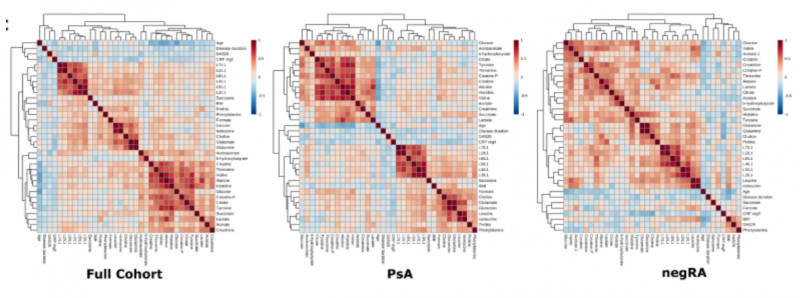 |
圖 5 顯示臨床或人口統計學變量與代謝物之間的 Pearson 相關系數,并使用歐幾里德度量對發現隊列的 PsA 和 negRA 組進行分層聚類。
用于患者分類的多元診斷模型
單一代謝物或脂質比例的 ROC 分析得到的曲線下面積(AUC) 小 70%。因此,單變量模型對 PsA 和 negRA 患者的鑒別的敏感性和特異性低。為了達到高的診斷準確率,研究者建立了三種不同的機器學習算法:隨機森林算法、樸素貝葉斯算法和多元 Logistic 回歸算法,對 73 例 PsA 和 49 例 negRA 患者的代謝組和脂質組進行了分析。隨機森林預測 PsA 的準確率 73.3%(Cohen‘s kappa 40.1%),樸素貝葉斯準確率為 63.7%(Cohen’s kappa 26.5%)。
通過逐步向前 - 向后選擇算法,以下診斷預測因子已包括在診斷模型中:年齡,性別,L6 / L1,L5 / L1,L2 / L1,丙氨酸,琥珀酸和磷酸肌酸。
在驗證過程中,使用十折交叉驗證對所得到的模型進行評估,這產生了表 1 中的系數估計。
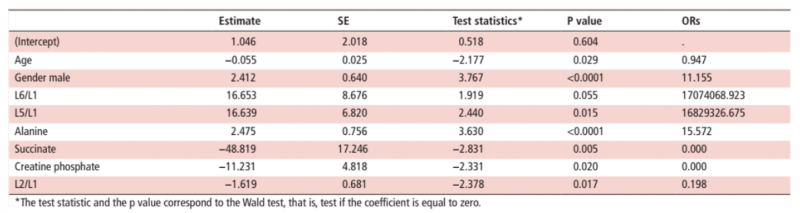 |
表 1 模型系數的評估
將這些估計值應用到回歸模型中會產生以下公式:
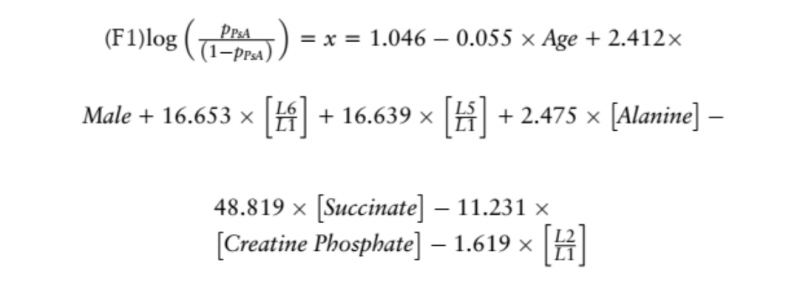 |
每種代謝物的濃度、年齡和性別(男性 =1,女性 =0) 代入公式中。然后,通過替換在 F1 中獲得的結果×來計算屬于 PsA 組的概率:
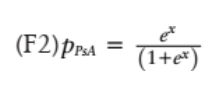
患者屬于 negRA 組的概率由下式給出:
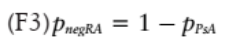
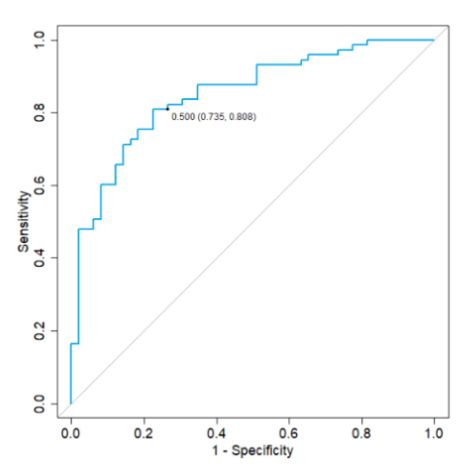
將患者分為兩組,需計算概率(F2) 的分界值。通常應用分界值 0.5,PPsA>0.5,則將其分類為 PsA,這反映了將對象分類為更有可能進行診斷的想法。圖 6 為發現隊列中交叉驗證的建模概率 PPsA 的 ROC 曲線,該圖顯示了該模型對此臨界值的敏感性和特異性,ROC 曲線下的總面積(AUC) 為 84.5%。
為了進一步驗證從交叉驗證過程中檢索到的模型,研究者收集了 35 名新的關節炎患者的單獨的盲法樣本。該隊列與用于建立診斷模型的隊列具有相似的路徑分布(圖 7)。使用臨界值 0.5 對盲法隊列進行評估,得出了 62.9% 的患者的正確預測,并進行了 ROC 分析,其中 AUC 降至 71.6%(圖 8)。
在診斷預測后,對 13 名預測診斷與風濕科醫生 zuì 初所做的診斷不同的患者進行了臨床重新評估。對于這些患者中的 4 名,仍然無法確定診斷,因為他們一直缺乏獨特的臨床參數。研究者從驗證隊列中刪除了這四個個體,重新計算了預測匹配率,增加到 71.0%,并進行了新的 ROC 分析,結果提高了敏感度(62.5%) 和特異度(80.0%)(圖 9)。
|
▲圖 6
 |
 |
▲ 圖 8
 |
結論
為驗證其在基因異源人群中的有效性,還需要在更大的多國 / 多民族隊列中進行測試。盡管如此,研究者的研究有助于將 1HNMR 的代謝組學這一技術擴展到自身免疫病理學的常規診斷技術鋪平道路。即使臨床特征相似,與風濕性疾病相關的代謝組學過程在疾病之間也有所不同。因此,代謝組學和脂質組學開始為自身免疫研究提供一個全新的領域。
參考文獻
Margarida souto-carneiro,lilla Tóth,rouven Behnisch,et al. Differences in the serum metabolome and lipidome identify potential biomarkers for seronegative rheumatoid arthritis versus psoriatic arthritis. Ann Rheum Dis.2020; 79(4):499-506.
更多伯豪生物服務