非編碼 RNA 在生命調控過程中扮演著重要角色,近年來的研究成果經常入選 CNS 年度十大科學突破。目前在高等生物中,存在著一個巨大的、尚未被完全發現的 RNA 世界。人類基因組轉錄區高達 76%,但轉錄產物中只有不到 2% 是編碼蛋白質的 mRNA,其他都是非編碼 RNA,其中 microRNA(miRNA)、長鏈非編碼 RNA(long non-coding RNA,lncRNA)、環狀 RNA(circularRNA,circRNA)等調控性 ncRNA 因其重要的調控功能,受到科學家們廣泛關注。近年來,非編碼 RNA 一直是生命科學領域的研究熱點,也是國家自然科學基金等鼓勵申報的重要領域。今天就跟大家分享幾篇近期發表的非編碼 RNA 相關研究的高分文章。
CH.01
miR-552-3p 調節肝臟糖脂代謝紊亂的功能及分子機制
miR-552-3p modulates transcriptional activities of FXR and LXR to ameliorate hepatic glycolipid metabolism disorder.
期刊:Journal of hepatology
影響因子:20.582
單位:中國科學院上海藥物研究所
上海交通大學醫學院附屬瑞金醫院
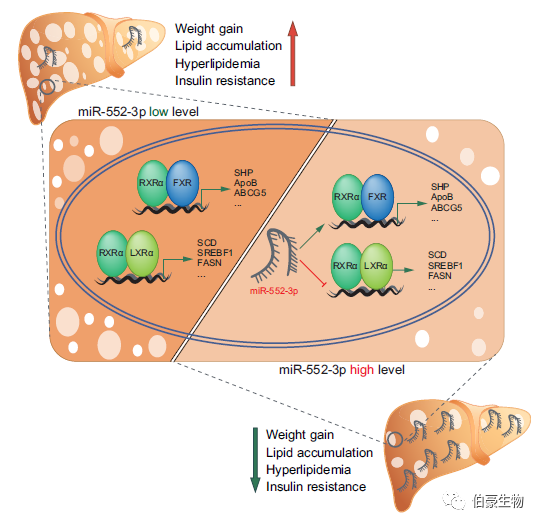
摘要:miRNA 的核定位已知十多年,但 miRNA 在細胞核中的確切功能尚未完全闡明。早前發現核內 miR-552-3p 對基因轉錄具有抑制作用,并含有特定的 AGGTCA 樣序列,即核受體 NR1 亞家族的順式元件。研究在探討 miR-552-3p 及其 AGGTCA 樣序列對 NR1s 的潛在影響及其在改善肝糖脂代謝中的可能應用。
該研究通過 RNA-seq、質譜和生物信息學,分析發現了 miR-552-3p 可以在細胞核內發揮調控肝 X 受體(LXR)和法尼醇 X 受體(FXR)下游基因的新生物學功能,并在多種動物模型中驗證了此 miRNA 對肝內糖脂代謝異常的改善作用。LXR 和 FXR 屬于代謝性核受體 NR1 家族成員,對肝內糖脂穩態調節發揮了重要作用。研究團隊隨后通過體外 FRET、ChIP、pull down、EMSA 等分子生物學技術,發現 miR-552-3p 序列中特有的與 NR1 家族響應元件類似的堿基排列,可與 LXR 響應元件(LXRE,DR4)序列的反義鏈結合,以及與 FXR 響應元件(FXRE,IR1)序列的正義鏈和反義鏈結合,從而影響它們的轉錄活性及下游糖脂代謝相關基因的表達。這一作用機制也在人的肝原代細胞上再次得到印證。此外,研究應用人的臨床樣本發現 miR-552-3p 與 NAFLD 病人肝脂蓄積程度和肝損傷的相關性。miR-552-3p 調節 LXRα 和 FXR 的機制揭示了 miRNA 介導的基因調控的新方法。此外,miR-552-3p 的體內和臨床相關性的有益效果表明它可能是治療糖脂代謝疾病的潛在治療靶點。
CH.02
環狀 RNA 調控膠質瘤發生新機制
Circular RNA CDR1as disrupts the p53/MDM2 complex to inhibit Gliomagenesis.

期刊:Mol Cancer
影響因子:15.302
單位:大連醫科大學腫瘤干細胞研究院
深圳市人民醫院
摘要:抑癌基因 p53 的失活對膠質瘤的發病機制至關重要,尤其是多形性膠質母細胞瘤(GBM)。MDM2 是 p53 的主要負調節因子,與 p53 結合形成穩定的復合物來調節其活性。迄今為止,尚不清楚 p53/MDM2 復合物的穩定性是否受環狀 RNAs 的影響。研究發現 CDR1as 與 p53 蛋白存在結合,CDR1as 的表達隨著膠質瘤分級的增加而降低,它是膠質瘤(尤其是 GBM)生存率的一個可靠的獨立預測因子。CDR1as 通過一種獨立于 miRNA 海綿的機制,通過防止 p53 蛋白泛素化來穩定 p53 蛋白。CDR1as 直接與 MDM2 結合所必需的 p53 DBD 結構域相互作用,從而破壞 p53/MDM2 復合物的形成。由 DNA 損傷誘導,CDR1as 可以保持 p53 功能并保護細胞免受 DNA 損傷。值得注意的是,CDR1as 在體外和體內抑制腫瘤生長,但在 p53 缺失或突變的細胞中幾乎沒有影響。
CDR1as 不是充當 miRNA 海綿,而是通過直接結合到其 DBD 區的 p53 來限制 MDM2 相互作用,從而起到抑癌作用。因此,CDR1as 結合會破壞 p53 / MDM2 復合物,從而阻止 p53 泛素化和降解。CDR1as 也可能感知 DNA 損傷信號并與 p53 形成保護性復合物以保留 p53 的功能。因此,CDR1as 耗竭可能通過下調神經膠質瘤中 p53 的表達來促進腫瘤發生。研究進一步拓寬了對環狀 RNA 的作用和作用機理的理解,尤其是 CDR1as 的作用,并可能為有效的神經膠質瘤治療開辟新的治療途徑。
CH.03
一種新的環狀 RNA,CIRC-CCAC1,有助于 CCA 的進展,誘導血管生成,并破壞血管內皮屏障
A novel circular RNA, circ-CCAC1, contributes to CCA progression, induces angiogenesis, and disrupts vascular endothelial barriers
期刊:Hepatology
影響因子:14.679
單位:哈爾濱醫科大學
▲技術路線
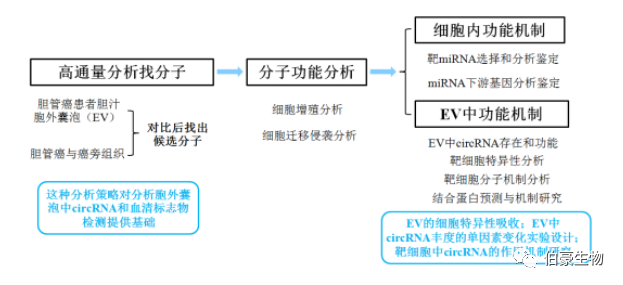
摘要:環狀 ENA(circRNAs)和細胞外囊泡(EVs)與多種惡性腫 瘤有關。本文旨在闡明膽管癌(CCA)細胞和 EVs 中失調的 circRNAs 的功能和機制。用 CircRNA 微陣列技術鑒定 CCA 組織和 EVs 中 CircRNA 的表達譜。采用 qRT-PCR 檢測膽管癌相關環狀 RNA-1(circ-CCAC1)的表達。通過 ROC 曲線、Fisher 高精度檢驗、Kaplan-Meier 圖和 Cox 回歸模型分析 circ-CCAC1 的臨床重要性。分別在 CCA 細胞和 HUVECs 中探討 circ-CCAC1 和外泌體 circ-CCAC1 的功能。采用不同的動物模型對體外實驗結果進行驗證。采用 RNA-seq、生物信息學、RIP、RNA pull down,ChIP,熒光素酶分析,qRT-PCR 來確定 CCA 細胞和 HUVEC 中 circ-CCAC1 的調控網絡。癌性膽汁 EVs 和組織中 Circ-CCAC1 水平升高,circ-CCAC1 在 CCA 患者中的診斷和預后價值被認可。對 CCA 細胞,circ-CCAC1 通過海綿化 miR-514a-5p 上調 YY1 來促進細胞的進展。同時,YY1 直接與 CAMLG 的啟動子結合,激活其轉錄。此外,CCA 衍生 EVs 的 circ-CCAC1 被轉移到內皮單層細胞,破壞內皮屏障的完整性并誘導血管生成。機制上,circ-CCAC1 通過將 EZH2 隔離在細胞質中,從而增加了 SH3GL2 的表達,從而降低了細胞間連接蛋白的水平。體內研究進一步表明,循環 EVs 和細胞中 circ-CCAC1 水平的增加促進了 CCA 腫瘤的發生和轉移。結論:Circ-CCAC1 在 CCA 腫瘤發生和轉移中起重要作用,可能是 CCA 的重要生物標志物治療靶點。
更多伯豪生物人工服務:


